
KATIONY
Kationami nazywany jony o ładunku dodatnim, czyli atomy bądź cząsteczki występujące w stanie niedomiaru elektronów. W procesie elektrolizy cząstki te wędrują do elektrody katodowej.
Kationy metali w klasyczny sposób dzieli się na 5 grup analitycznych, ułożonych wedle reguł Freseniusa:
I grupa: Ag+, Pb2+ i Hg22+, Tl+,Cu+, Au+.
II grupa: Cd2+, Bi3+, Cu2+, As3+, As5+, Sb3+, Sb5+, Sn2+, Sn4+, Hg2+.
III grupa: Zn2+, Ni2+, Co2+, Mn2+, Fe2+, Fe3+, Al3+, Cr3+.
IV grupa: Ca2+, Sr2+, Ba2+
V grupa: Mg2+, Li+, Na+, K+, NH4+
Dla każdej grupy stosuje się inne, charakterystyczne reakcje wykrywania, polegające na użyciu konkretnego dla danej grupy odczynnika grupowego. Jeśli dany odczynnik grupowy spowodował wytrącenie osadu, oznacza to, iż kation znajdujący się w roztworze faktycznie należy do tej grupy.
Dla grupy I odczynnikiem grupowym jest 1-molowy roztwór kwasu solnego. Chlorki kationów grupy I są trudnorozpuszczalne i białe. Chlorki pozostałych kationów są związkami dobrze bądź bardzo dobrze rozpuszczalnymi w wodzie.
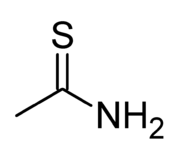
Dla grupy II odczynnikiem grupowym był niegdyś siarkowodór. Ze względu jednak na normy bezpieczeństwa, jakie muszą panować w labolatoriach, związek ten zastąpiono substancją o skrótowej nazwie AKT (tioacetamidem ; CH3CSNH2), występującym najczęściej w środowisku rozcieńczonego HCl. Próbę taką należy wykonać w łaźni wodnej. AKT jest doskonałym źródłem anionów siarczkowych ; a to właśnie na użyciu tych anionów S2- polega próba grupy II analitycznej. Kationy tej grupy tworzą nierozpuszczalne w wodzie i w kwasach siarczki. Na rysunku ; jako ciekawostka ; wzór strukturalny AKT:
Odczynnikiem grupowym III grupy kationów może być r11; podobnie, jak w przypadku grupy II - dowolne źródło anionów S2-, koniecznie występujące w środowisku obojętnym, względnie słabo kwaśnym. Najwygodniejszym odczynnikiem ponownie okazuje się tioacetamid (AKT), do którego dodaje się kilka kropli wody amoniakalnej i chlorku amonu. Próbę taką należy wykonać w łaźni wodnej. Ponadto, przydatna okazuje się znajomość charakterystycznych kolorów niektórych jonów (grupa III jest najobfitsza w jony rkolorower1;) np. Fe2+ ma kolor jasnożółty, Fe3+ ciemnożółty, Mn2+ lekko różowy, Co2+ czerwony itp.
IV grupa kationów, to jony tworzące nierozpuszczalne w wodzie węglany. Odczynnikiem grupowym jest węglan amonu (NH4)2CO3 w środowisku buforu amonowego (NH3*H2O i NH4Cl). Nie jest to jednak reakcja najlepiej charakteryzująca poszczególne jony ; zdecydowanie bardziej specyficzną reakcją jest reakcja strącania siarczanów. Siarczany baru i strontu są bardzo słabo rozpuszczalne, podczas gdy siarczan wapnia ; rozpuszcza się o rząd wielkości lepiej. Dodatkowo, warto kationy te rozróżniać na zasadzie badania w płomieniu palnika. Jony wapnia barwią płomień na kolor ceglastoczerwony, strontu ; na karminowoczerwony, baru; zółtozielony.
Jak widać; V grupa kationów, to grupa zrzeszająca te jony, które z reguły tworzą związki łatwo rozpuszczalne, nie tworzące osadu. Jedyną, praktycznie wykorzystywaną w analizie jakościowej próbą dla tych związków są próby płomieniowe bądź zapachowe.
Nazwy poszczególnych kationów:
Ag+ - kation srebrowy,
Pb2+ - kation ołowiowy,
Hg22+ - kation rtęciowy (I), zwany anionem kalomelowym,
Tl+ - kation talowy,
Cu+ - kation miedzi (I),
Au+ - kation złota,
Cd2+ - kation kadmowy,
Bi3+ - kation bizmutu,
Cu2+ - kation miedzi (II),
As3+ - kation arsenu (III),
As5+ - kation arsenu (V),
Sb3+ - kation antymonu (III),
Sb5+ - kation antymonu (V),
Sn2+ - kation cynowy (II),
Sn4+ - kation cynowy (IV),
Hg2+ - kation rtęciowy (II)
Zn2+ - kation cynkowy,
Ni2+ - kation niklowy,
Co2+ - kation kobaltu,
Mn2+ - kation manganu (II),
Fe2+ - kation żelaza (II),
Fe3+ - kation żelaza (III),
Al3+ - kation glinu,
Cr3+ - kation chromu,
Ca2+ - kation wapniowy,
Sr2+ - kation strontu,
Ba2+ - kation baru,
Mg2+ - kation magnezowy,
Li+ - kation litowy,
Na+ - kation sodowy,
K+ - kation potasowy,
NH4+ - kation amonowy.
Ciekawym kationem jest także kation nitroniowy; NO2+ który powstaje w mieszaninie nitrującej z kwasu azotowego(V) pod wpływem katalizującego działania protonu, pochodzącego od kwasu siarkowego(VI). Sprotonowany kwas azotowy po odłączeniu cząsteczki wody przechodzi właśnie w jon nitroniowy.
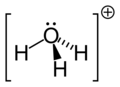
Równie ciekawym jest też jon hydroniowy, będący swoistego typu wyznacznikiem kwasowości roztworów. Jest to uwodniony kation wodorowy; H3O+. Istnieje tylko w roztworach wodnych, gdzie powstaje w wyniku autodysocjacji wody oraz dysocjacji kwasów. Ulega on później dalszej hydratacji. Jest silnym kwasem Lewisa, jego pKa w temperaturze pokojowej równa się -1,7.
ANIONY
Anionami nazywany jony o ładunku ujemnym, czyli atomy bądź cząsteczki występujące w stanie nadmiaru elektronów. W procesie elektrolizy cząstki te wędrują do elektrody anodowej.
Kationy metali w klasyczny sposób dzieli się na 7 grup analitycznych,w których brak jest prostych odczynników grupowych. Analiza najczęściej polega na miareczkowaniu kationami IV grupy, a konkretnie jonami Ba2+, ewentualnie jonem Ag+. Grupy te to:
I grupa: Cl-, Br-, I-, CN-, SCN-, Fe(CN)63-, Fe(CN)64-, ClO-
II grupa: S2-, NO2-, CH3COO-
III grupa: SO32-, CO32-, C2O42-, BO2-, BO33-, C4H4O62-
IV grupa: PO43-, AsO43-, AsO33-, S2O32-, CrO42-, Cr2O72-
V grupa: NO3-, MnO4-, ClO3-, ClO4-
VI grupa: SO42-, F-, SiF62-.
VII grupa: SiO32-, SiO44-, Si2O52-
Aniony I grupy tworzą z Ag+ białe osady nierozpuszczalne w rozcieńczonym kwasie azotowym. Nie tworzą one osadu z Ba2+.
Aniony grupy II r11; podobnie jak aniony grupy I - tworzą białe osady z Ag+, nie tworzą natomiast osadów z Ba2+. Można je jednak odróżnić po tym, że osady z Ag+ rozpuszczają się w rozcieńczonym kwasie azotowym.
W grupie III aniony, podobnie jak aniony II grupy, tworzą z Ag+ osady rozpuszczalne w rozcieńczonym kwasie azotowym.W przeciwieństwie jednak do nich tworzą białe osady z Ba2+.
Aniony IV grupy tworzą osady z Ag+ oraz Ba2+. Ich osady z Ba2+ są białe (z wyjątkiem CrO42-, który daje osad żółty) i rozpuszczalne w rozcieńczonym kwasie azotowym. Charakterystyczne jest to, że ich osady z Ag+ są barwne, co pozwala odróżnić te aniony od anionów grupy III.
Aniony V grupy prawie w ogóle nie tworzą osadów. Przede wszystkim nie tworzą one osadów z Ag+ ani Ba2+. Jon MnO4- można poznać po intensywnym foletowym zabarwieniu, które znika po dodaniu odpowiedniego reduktora, zaś jon NO3- można wykryć za pomocą tzw. próby obrączkowej, czyli próby z użyciem nasyconego roztworu siarczanu żelaza(II), zakwaszonego odpowiednio rozcieńczonym kwasem siarkowym.
Grupa VI - aniony te tworzą osady z Ba2+, nie tworzą natomiast osadów z Ag+.
Grupę siódmą stanowią jony krzemianowe, które w środowisku kwaśnym tworzą charakterystyczny żel krzemionkowy, o galaretowatej konsystencji, łatwy do rozpoznania.
Nazwy poszczególnych anionów:
Cl-: anion chlorkowy,
Br- : anion bromkowy,
I- : anion jodkowy,
CN- : anion cyjankowy,
SCN- : anion tiocyjankowy,
Fe(CN)63-: anion żelazicyjankowy,
Fe(CN)64-: anion żelazocyjankowy,
ClO- : anion chlorowy (I),
S2- : anion siarczkowy,
NO2- : anion azotanowy (III),
CH3COO- : anion octowy,
SO32- : anion siarkowy (IV),
CO32- : anion węglowy (IV),
C2O42- : anion szczawianowy,
BO2- : anion oksoboranowy (III),
BO33- : anion ortooksoboranowy ,
C4H4O62- : anion winowy,
PO43- : anion fosforanowy (V),
AsO43- : anion arsenowy (V),
AsO33- : anion arsenowy (III),
S2O32-: anion tiosiarczanowy,
CrO42- : anion chromianowy (VI),
Cr2O72- : anion dichromianowy (VI),
NO3- : anion azotowy (V),
MnO4- : anion manganowy (VII),
ClO3- : anion chlorowy (V),
ClO4- : anion chlorowy (VII),
SO42- : anion siarkowy (VI),
F- : anion fluorkowy,
SiF62- : anion fluorokrzemianowy,
SiO32- : anion krzemianowy (IV).
Podobnie, jak w wypadku kationów, tak i wypadku anionów występuje co najmniej jeden, który ciekawi badaczy. Jest to jon sulfonowy HSO3-, dołączający się często do związków organicznych i zmieniający diametralnie ich właściwości.
Grafika, wzory: Wikipedia
Źródło: devitto
