
Litowce, zwane również metalami alkalicznymi, są najbardziej aktywnymi metalami, które należy przechowywać pod warstwą nafty, aby zapobiec reakcjom ze składnikami powietrza. W odróżnieniu od większości metali, są one tak miękkie, że można je kroić nożem. Po przecięciu odsłonięta powierzchnia szybko matowieje na skutek utleniania. Litowce są bardzo łatwo topliwe, np. cez topi się już w temperaturze 28oC.
Reaktywność metali alkalicznych rośnie wraz z numerem okresu, do którego dany metal należy. Najmniej reaktywny jest lit, najbardziej-frans. Litowce są jednowartościowe we wszystkich związkach.
Reagują z:
-tlenem, tworząc tlenki zasadowe lub nadtlenki, np.:
4Li+O2 --> 2Li2O
2Na+O2 --> Na2O2
-wodą, tworząc wodorotlenki i wodór, np.:
2K+2H2O --> 2KOH+H2
-kwasami, tworząc sole i wodór, np.:
2Rb+2HCl --> 2RbCl+H2
-niemetalami, tworząc sole, np.:
2Cs+Cl2 --> 2CsCl
- alkoholami, tworząc alkoholany, np.:
2Na+2C2H5OH --> 2C2H5ONa+H2
Litowce są silnymi reduktorami i pierwiastkami o najniższej elektroujemności. Ich sole bardzo dobrze rozpuszczają się w wodzie, a wodorotlenki należą do najsilniejszych zasad.
Występowanie:
Metale alkaliczne nie występują w przyrodzie w stanie wolnym, lecz jako składniki minerałów(saletry, halit, sylwin, karnalit, lepidolit i inne). Litowce obecne są także w wodzie morskiej jako składniki rozpuszczonych soli. W przyrodzie najwięcej jest sodu i potasu, natomiast cięższe litowce występują w bardzo małej ilości.
Otrzymywanie:
Lit, sód i potas otrzymuje się przez elektrolizę ich stopionych soli. Otrzymywanie rubidu i cezu jest bardziej skomplikowane, natomiast frans można otrzymać wyłącznie w wyniku przemian jądrowych.
Identyfikacja:
Sole metali I grupy układu okresowego są dobrze rozpuszczalne w wodzie, więc nie tworzą żadnych osadów. Roztwory soli litowców są bezbarwne. Jedyną prostą metodą identyfikacji jonów tych metali jest tzw. analiza płomieniowa. Polega ona na zanurzeniu wyżarzonego pręcika platynowego lub grafitowego w roztworze badanej soli, a następnie wprowadzenie go do bezbarwnego płomienia palnika. Obecność jonów litowców powoduje zmianę barwy płomienia.
Analiza płomieniowa litu:

Analiza płomieniowa sodu:
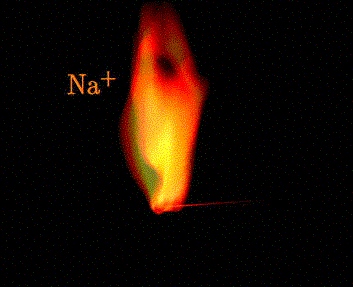
Analiza płomieniowa potasu:

Analiza płomieniowa cezu:

Lit Li
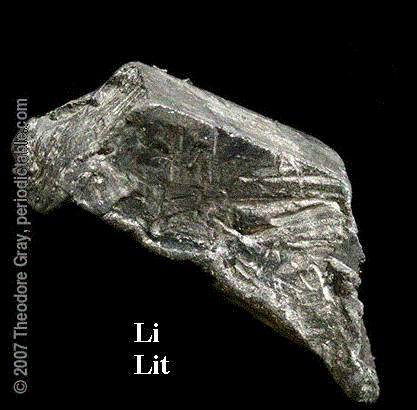
Liczba atomowa: 3
Masa atomowa: 6.941u
Gęstość: 0.53g/cm3
Temp topn : 180oC
Temp wrz : 1342oC
Lit jest srebrzystobiałym, miękkim metalem i zarazem najlżejszym pierwiastkiem stałym. Szybko reaguje z wodą, jednak mniej energicznie niż inne metale I grupy. Odkrywcą litu jest Johann Arfendson, a data odkrycia to rok 1812
Lit jest stosowany m.in. w technice jądrowej, metalurgii, do uszlachetniania stali, do produkcji wydajnych baterii, a także jako dodatek do smarów.
Reakcja litu z wodą:
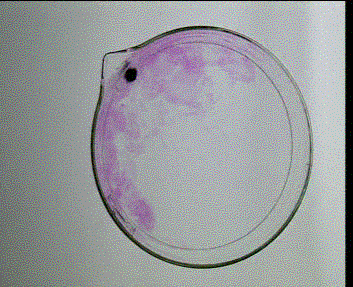
Sód Na

Liczba atomowa: 11
Masa atomowa: 22.989u
Gęstość: 0.97g/cm3
Temp topn : 98oC
Temp wrz : 883oC
Sód jest miękkim, lekkim, kowalnym metalem o srebrzystobiałej barwie i (w atmosferze ochronnej; bez dostępu powietrza) silnym, metalicznym połysku. W układzie okresowym sód zajmuje miejsce pod litem, a więc ma od niego większą aktywność. Na powietrzu bardzo szybko matowieje, a z wodą reaguje gwałtowniej od litu. Sód odkrył w roku 1807 sir Humpry Davy.
Metal ten ma zastosowanie w wielu gałęziach przemysłu: w metalurgii jako domieszka do stali, w technice jądrowej, w wielu syntezach organicznych (np. synteza Wurtza), w lampach sodowych, a także do produkcji licznych związków nieorganicznych.
Najważniejsze związki: wodorotlenek sodu NaOH, chlorek sodu NaCl.
Potas K

Liczba atomowa: 19
Masa atomowa: 39.09u
Gęstość: 0.86g/cm3
Temp topn : 63oC
Temp wrz : 759oC
Potas ma właściwości podobne do sodu, jest jednak od niego dużo bardziej aktywny. Na powietrzu bardzo szybko się utlenia, czasem dochodzi do zapłonu. Podczas reakcji z wodą wydziela się tyle energii, że powstający wodór ulega zapaleniu i często wybuchowi. Potas został odkryty wraz z sodem w 1807 przez tego samego chemika. Rola potasu w przemyśle jest ograniczona ze względu na jego aktywność i wysoką cenę. Promieniotwórczy izotop 40K jest stosowany w badaniach chemicznych i biologicznych oraz w geochronologii, czyli określaniu wieku skał.
Reakcja potasu z wodą:


Reakcja potasu z chlorem:

Rubid Rb

Liczba atomowa: 37
Masa atomowa: 85.468u
Gęstość: 1,53g/cm3
Temp topn : 39oC
Temp wrz : 688oC
Rubid-położony w V okresie jest jeszcze bardziej reaktywny. Na powietrzu zapala się samorzutnie, gwałtownie reaguje z wodą; reakcji zawsze towarzyszy eksplozja wodoru. W ciepły dzień roztapia się. Rubid odkryli w 1860r. Robert Bunsen i Gustav Krihoff metodą spektroskopii. Rubid znalazł zastosowanie do pokrywania komórek fotoelektrycznych i jako dodatek do specjalistycznego szkła laboratoryjnego.
Cez Cs
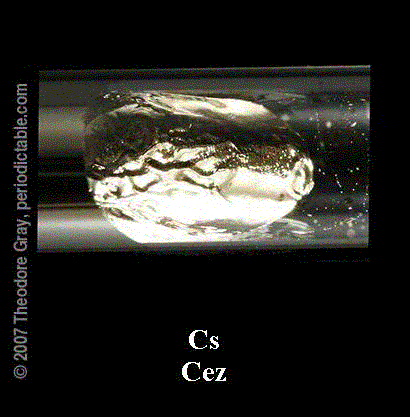
Liczba atomowa: 55
Masa atomowa: 132.905u
Gęstość: 1.87g/cm3
Temp topn : 28oC
Temp wrz : 671oC
Srebrzystobiały cez jest najaktywniejszym i najmniej elektroujemnym (nie licząc fransu) pierwiastkiem. Odkryty został wraz z rubidem. W niesamowicie gwałtownej reakcji z wodą tworzy najsilniejszą znaną zasadę- CsOH. Na wolnym powietrzu może wybuchnąć. Cezu używa się do produkcji fotodiod, a jego parami zmieszanymi z argonem wypełnia się lampy elektronowe. Metal ten jest także źródłem napędu rakietowego poza atmosferą ziemską. Ze względu na jego łatwość pochłaniania tlenu używa się go w technice próżniowej. Promieniotwórczy izotop 137Cs to przydatny półprodukt reakcji jądrowych. Izotop ten jest także używany jako źródło promieniowania gamma w defektoskopii oraz w medycynie jako tzw. znacznik promieniotwórczy, gdzie powoli wypiera stosowany do niedawna rad.
Frans Fr
Liczba atomowa: 87
Masa atomowa: 223.02u
Najcięższy ze znanych metali alkalicznych. Śladowe ilości występują w naturze w rudach uranowych. Szacuje się, że w całej skorupie ziemskiej jest najwyżej kilkanaście gramów tego pierwiastka. Wszystkie jego izotopy są promieniotwórcze i bardzo nietrwałe. Najbardziej trwały jest 223Fr (T 1/2=22min). Frans odkryła w 1939r. Marguerite Perey. Ze względu na bardzo nietrwały charakter tego pierwiastka, większość jego właściwości fizykochemicznych nadal pozostaje tajemnicą.
Źródło: adi93
