I znów ktoś uderzył w stół i nożyce musiały się odezwać… :). Tym razem tym „uderzającym” był Grzegorz Mniejszy. Zamieścił świetny tekst na temat zamarzania wody, płatków śniegu itd. Nie mogłem więc nie zareagować – jako „Jańcio Wodnik”. Tyle, że Grzesiu, biedne chłopię, nie zdaje sobie sprawy z tego, że wdaje się w niebezpieczne rozgrywki :). Bo rozdziawia buzię z zadziwienia i zachwytu nad cudownością zwykłej przecież wody. A to grozi konsekwencjami – począwszy od oskarżeń o oddawanie czci bałwanom – przecie na morzu mnóstwo wodnych bałwanów, a i na zwykłym śniegu też bałwany pojawiają się. Faktem jest, że w tym przypadku największym bałwaństwem i bałwanieniem mogą być jedynie dziwaczne oskarżenia o oddawanie boskiej czci wodnym bałwanom, ale też wiemy wszyscy, że ludziska barwni bywają w swoich poglądach – osobliwie ci, których szczególnie zajmuje zbawianie innych od ognia piekielnego i wstrętnego smrodu siarki.
Tak więc, Grzegorzu, nie wiem, czy miałeś do końca świadomość, co robisz. I właśnie dlatego, abyś samotnie nie skwierczał na piekielnej patelni, albo samotnie nie był batożony przy piekielnym pręgierzu – dotrzymam Ci towarzystwa. Bowiem zdobyłem-ci już pewne doświadczenia w potyczkach z piekielną bracią, która próbowała dokonywać cudów na wzór Mistrza z Kany Galilejskiej. Tyle, że tamten przemieniał wodę w szlachetne wino, a ci próbują robić wodę z mózgów… Ad rem jednak. O zamarzaniu wody przecież miało być i śniegowych płatkach…
**********************************************************************************************************************
Nie ma dwóch jednakowych płatków śniegu, choć każdy z nich ma kształt symetrycznego sześciokąta (układ heksagonalny). Wszystkie są zbiorem kryształków lodu powstałych z zamarzniętej pary wodnej. Każdy płatek śniegu, który zawiera około 1018 cząsteczek wody. Klasyfikacja kryształów lodu wyróżnia ok. 80 ich rodzajów. Kształt płatka zależy od temperatury, wysokości i zawartości wody w chmurze, w której tworzy się płatek.
Kryształki lodu tworzą się w chmurach o temperaturze w przedziale minus 200 C, a minus 400C. Zarodnikiem kryształów powstających z wody są zwykle mikroskopijne zanieczyszczenia w postaci pyłków, drobin kurzu czy cząsteczek dymu. Powstały w chmurach kryształek lodu ma średnicę nie większą kilka dziesiątych milimetra.
Podczas opadania i procesu resublimacji, czyli bezpośredniego przejścia wody ze stanu pary w lód, kryształki lodu rozrastają się, łączą się ze sobą i topiąc się sklejają w płatki, po czym ponownie zamarzają. W postaci śniegu spadną na Ziemię jedynie wówczas, kiedy temperatura powietrza będzie mniejsza od 00 C. Każdy kryształek lodu ma strukturę heksagonalną, występuje więc w postaci płytki o sześciokątnym kształcie. Z sześciokątnego płatka wyrasta z czasem sześcioramienna gwiazdka. Złożoność formy płatka i jego wielkość zależą w pierwszym rzędzie od wilgotności (im większa wilgotność, tym bardziej złożone powstają kształty) oraz temperatury (-200C÷-100C).
Jeśli będzie za ciepło, to kryształki zamienią się w parę lub stopnieją się i spadną jako deszcz lub deszcz ze śniegiem.
 Płatki śniegu topniejąc się tworzą deszcz. Kropla deszczu składa się z milionów mikroskopijnych kropelek pary wodnej. W tej jednej kropli jest więcej cząsteczek wody niż gwiazd na niebie. Myślę, że zaskoczyć może nas fakt, że krople deszczu mają kształt spłaszczonej piłki. Nie są więc ani okrągłe, ani nie mają kształtu łez. W dodatku zarówno płatki śniegu jak i krople deszczu są naładowane ujemnym ładunkiem elektrycznym. Wiedz więc, że deszcz – to życiodajne krople o ujemnym ładunku elektrycznym powstającym na skutek tzw. zjawiska tryboelektrycznego przy rozbijaniu kropel wody (tryboelektryczność - zjawisko powstawania ładunków elektrycznych podczas tarcia różnych ciał o siebie). I to właśnie ładunki ujemne sprawiają, że tak rześko czujemy się po burzy lub po kąpieli.
Płatki śniegu topniejąc się tworzą deszcz. Kropla deszczu składa się z milionów mikroskopijnych kropelek pary wodnej. W tej jednej kropli jest więcej cząsteczek wody niż gwiazd na niebie. Myślę, że zaskoczyć może nas fakt, że krople deszczu mają kształt spłaszczonej piłki. Nie są więc ani okrągłe, ani nie mają kształtu łez. W dodatku zarówno płatki śniegu jak i krople deszczu są naładowane ujemnym ładunkiem elektrycznym. Wiedz więc, że deszcz – to życiodajne krople o ujemnym ładunku elektrycznym powstającym na skutek tzw. zjawiska tryboelektrycznego przy rozbijaniu kropel wody (tryboelektryczność - zjawisko powstawania ładunków elektrycznych podczas tarcia różnych ciał o siebie). I to właśnie ładunki ujemne sprawiają, że tak rześko czujemy się po burzy lub po kąpieli.
Niezwykły jest też proces zamarzania wody. W miarę ochładzania się woda w jeziorach, rzekach i morzach staje się cięższa i opada głębiej, wskutek czego lżejsza i cieplejsza woda jest wypychana na powierzchnię. Kiedy zbliża się jednak punkt krzepnięcia, proces ten odwraca się! Zimna woda po obniżeniu się temperatury poniżej 3,980C zaczyna zwiększać swoją objętość. Inaczej rzecz ujmując, woda w miarę spadku temperatury do granicy 3,980C początkowo zwiększa swą masę właściwą, czyli gęstość (w wyniku zmniejszenia objętości), która przyjmuje maksymalną wartość w temperaturze 3,980C (objętość wówczas jest najmniejsza). Do dziś nikt nie wie, dlaczego woda ma maksymalna gęstość właśnie w temperaturze 3,980C.
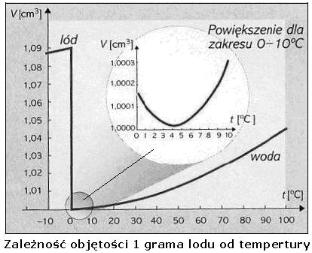
Przy dalszym ochładzaniu i zmniejszaniu się temperatury od 3,980C do 00C woda rozszerza się, czyli ponownie zwiększa się jej objętość, a gęstość maleje. W chwili zaś zamiany w lód, w temperaturze 00C, objętość jej wzrasta skokowo aż o 10%. Dlaczego tak się dzieje? A otóż dlatego, że w temperaturze poniżej 3,980C molekuły wody intensywnie asocjują tworząc większe skupiska. W efekcie w temperaturze 00C tworzy się heksagonalna (sześciokątna) struktura lodu z dużymi, otwartymi przestrzeniami między ściankami tworzących się kryształów. Skutkuje to wspomnianym gwałtownym skokiem objętości fazy stałej w porównaniu z fazą ciekłą. Wynikiem tego jest, że każdy jeden cm3, dm3, m3 wody staje się lżejszy. Powoduje to unoszenie lżejszej wody ku powierzchni, gdzie zamarza. Po zamarznięciu pływa po powierzchni w postaci lodu.
 Lód działa jak izolator ponieważ charakteryzuje się złym przewodnictwem cieplnym i zabezpiecza głębsze warstwy wody przed zamarzaniem, chroniąc w ten sposób żyjące tam organizmy. Warto wspomnieć, że głębsze, zimne warstwy wody są lepiej dotlenione, ponieważ gazy lepiej rozpuszczają się w wodzie w niskich temperaturach. Dzieje się to wszystko na skutek nietypowego układu wiązań cząsteczek wody. W przypadku zamarzania wody następuje zamiana wiązań bardziej gęstych na luźniejsze, dzięki czemu ta sama masa wody musi zwiększyć swoją objętość. Gdyby woda nie miała tej niepowtarzalnej cechy, wówczas każdej zimy opadałoby na dno coraz więcej lodu, gdzie następnego lata promienie słoneczne nie zdołałyby go roztopić. W krótkim czasie woda w większości rzek i jezior, a nawet mórz zamieniłaby się w lód. Czy dostrzegamy już teraz ten cud natury? Oprócz tego zwykły lód nie jest taki „zwykły”. Jak twierdzi dr Peter Augustin, niemiecki lekarz i naukowiec zajmujący się badaniami wody, istnieje 12 różnych stanów lodu, różniących się typem sieci krystalicznej i odpowiednio właściwościami fizyko-chemicznymi, m.in. gęstościami zawierającymi się w przedziale 0,92÷1,5g/cm3. Ta druga skrajna wielkość
Lód działa jak izolator ponieważ charakteryzuje się złym przewodnictwem cieplnym i zabezpiecza głębsze warstwy wody przed zamarzaniem, chroniąc w ten sposób żyjące tam organizmy. Warto wspomnieć, że głębsze, zimne warstwy wody są lepiej dotlenione, ponieważ gazy lepiej rozpuszczają się w wodzie w niskich temperaturach. Dzieje się to wszystko na skutek nietypowego układu wiązań cząsteczek wody. W przypadku zamarzania wody następuje zamiana wiązań bardziej gęstych na luźniejsze, dzięki czemu ta sama masa wody musi zwiększyć swoją objętość. Gdyby woda nie miała tej niepowtarzalnej cechy, wówczas każdej zimy opadałoby na dno coraz więcej lodu, gdzie następnego lata promienie słoneczne nie zdołałyby go roztopić. W krótkim czasie woda w większości rzek i jezior, a nawet mórz zamieniłaby się w lód. Czy dostrzegamy już teraz ten cud natury? Oprócz tego zwykły lód nie jest taki „zwykły”. Jak twierdzi dr Peter Augustin, niemiecki lekarz i naukowiec zajmujący się badaniami wody, istnieje 12 różnych stanów lodu, różniących się typem sieci krystalicznej i odpowiednio właściwościami fizyko-chemicznymi, m.in. gęstościami zawierającymi się w przedziale 0,92÷1,5g/cm3. Ta druga skrajna wielkość  oznacza, że lód o takiej gęstości absolutnie nie może pływać – nawet w częściowym zanurzeniu. Czym więc charakteryzuje się jego lodowa struktura? Większość z takich struktur lodowych istnieje wyłącznie przy wysokich ciśnieniach i niskich temperaturach.
oznacza, że lód o takiej gęstości absolutnie nie może pływać – nawet w częściowym zanurzeniu. Czym więc charakteryzuje się jego lodowa struktura? Większość z takich struktur lodowych istnieje wyłącznie przy wysokich ciśnieniach i niskich temperaturach.
Mechanizm zamarzania wody jest, jak więc widać, niezwykły. Żadne inne ciecze nie wykazują podobnych cech i nie zachowują się podobnie. Jednak jeszcze większe zadziwienie wzbudza fakt, że znacznie łatwiej zamarza woda… gorąca (!), niż woda zimna. Zjawisko to znane jest nauce jako „efekt Mpemby” ( o czym więcej tu: http://www.eioba.pl/a/2te8/dlaczego-woda-goraca-zamarza-szybciej-niz-woda-zimna-czyli-o-efekcie-mpemby
Fragment książki „SEKRETY WODY”
Autor: Janusz Dąbrowski
Wszelkie prawa zastrzeżone
