POJĘCIE GAZU DOSKONAŁEGO
W fizyce bardzo często mamy do czynienia z modelami - idealizacjami pewnych zjawisk. Dzięki nim możemy chociaż w przybliżeniu opisywać pewne procesy, które zachodzą w rzeczywistości. W tym rozdziale będziemy częto posługiwać się modelem gazu doskonałego:
Gaz doskonały - definicja
Jedynym rodzajem oddziaływań cząsteczek w gazie doskonałym są zderzenia sprężyste pomiędzy cząsteczkami oraz ze ściankami naczynia.
Objętość cząsteczek gazu doskonałego jest zaniedbywalnie mała w porównaniu z objętością naczynia.
Gazy rzeczywiste zachowują się jak gaz doskonały tylko w odpowiednich warunkach: w wysokiej temperaturze (energia kinetyczna cząsteczek jest na tyle duża, że można zaniedbać energię oddziaływań elektromagnetycznych) i niskim ciśnieniu (gaz jest rozrzedzony, a dzięki temu rozmiary cząsteczek są małe w porównaniu do odległości między nimi).
Model ten ma zastosowanie do wszystkich gazów rzeczywistych, ale istnieją granice jego zastosowania, z którymi wiąże się kolejne pojęcie:
Temperatura zera bezwzględnego - definicja
Jest to najniższa temperatura, do której możemy się zbliżać, ale jej osiągnięcie jest niemożliwe (ciśnienie i objętość musiałyby być równe zeru). W temperaturze tej zanika całkowicie ruch cząsteczek. Temperatura ta jest równa -273,15 oC lub 0 K (kelwinów).
Skala Kelvina nazywana jest również bezwzględną skalą temperatur. Jednostkowy przyrost temperatury w obydwu skalach jest taki sam:
Δt = 1oC = 1KT = t(oC) + 273,15 T - temp. w kelwinach
RÓWNANIE STANU GAZU DOSKONAŁEGO - RÓWNANIE CLAPEYRONA
Równanie Clapeyrona pokazuje zależność pomiędzy trzema jego właściwościami, które pozwalaja opisać go oraz wpływają na jego zachowanie: ciśnieniem, temperaturą i objętością.
Z teorii kinetyczno-molekularnej wiemy, że:
Rozpatrzmy teraz 1 mol gazu (mol to nie taki denerwujący owad, ale jednostka liczności materii, to powinno być na chemii :) Dla 1 mola gazu N = NA (NA - stałą Avogadro) - w jednym molu substancji jest zawsze tyle samo cząsteczek - 6,022 . 1023 - i to jest właśnie NA. Zatem można zapisać: (pV)/T = kNA Pojawia się już ostatnia stała w tym wyprowadzeniu, ale stała bardzo ważna - R - stała gazowa (R = 8,31 J / (mol . K)) : R = kNA Zatem po podstawieniu: (pV)/T = RDla n moli gazu: (pV)/T = nR
Po przekształceniu otrzymujemy równanie Clapeyrona:
pV = nRT n = m/M jak wiadomo z chemii :) gdzie m to masa substacji, a M to masa molowe tej substancji. Zatem można zapisać jeszcze jedną postać tego równania: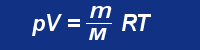
PRZEMIANY GAZOWE
Dla wszystkich przemian prawdziwa jest zależność:
(p1V1)/T1 = (p1V2)/T2 czyli, innymi słowy stosunek iloczyny ciśnienia i objętości do temperatury gazu jest zawsze taki sam.Przemiana izotermiczna jest nazywana również prawem Boyle'a - Mariotte'a. Jak sama nazwa wskazuje, w przemianie tej temperatura nie ulega zmianie:
T = const w związku z tym również: pV = const
Wykres ten przedstawia zależność ciśnienia od objętośći dla gazu w przemianie izotermicznej. Krzywa ta nazywa się izotermą.
Przemiana izohoryczna stałej masy gazu charakteryzuje się niezmiennością objętości. Przyrost ciśnienia jest wprost proporcjonalny do przyrostu temperatury.
V = const

Równanie tej prostej, zwanej również izochorą można zapisać :
p = (Δp / Δt) . t + p0Przemiana izobaryczna zachodzi, gdy ciśnienie stałej masy gazu nie ulega zmianie. Przyrots objętości jest wprost proporcjonalny do przyrostu temperatury.
p = constRównaniej tej prostej zwanej izobarą można zapisać:
V = (ΔV / Δt) . t + V0
Źródło: http://www.superfizyka.za.pl/
